قد يُمثل الحديث عن خواص المركبات الأيونية والتساهمية طريقة لطيفة لفهم كيف ترتبط المواد ببعضها، فالبعض يرى أن خواص المركبات الأيونية توضّح قوة ترابطها، كما هو الحال عند دراسة أمثلتها الشائعة، وعند آخرين قد يكون تعريف هذه المركبات مدخلًا مبسطًا يساعدهم على التمييز بينها وبين المركبات التساهمية، تمامًا كما يظهر ذلك عند مقارنة خصائص النوعين أو الاطلاع على جدول المركبات الأيونية الذي سنبرزه فيما هو قادم.
خواص المركبات الأيونية
- تتكوّن المركبات الأيونية نتيجة التجاذب القوي بين الأيونات الموجبة والسالبة، وهو تجاذب يُنشئ روابط أيونية شديدة المتانة تمنح هذه المركبات خصائص مميزة.
- وبفضل قوة هذه الروابط، تمتلك المركبات الأيونية درجات انصهار وغليان مرتفعة للغاية مقارنة بغيرها من المركبات.
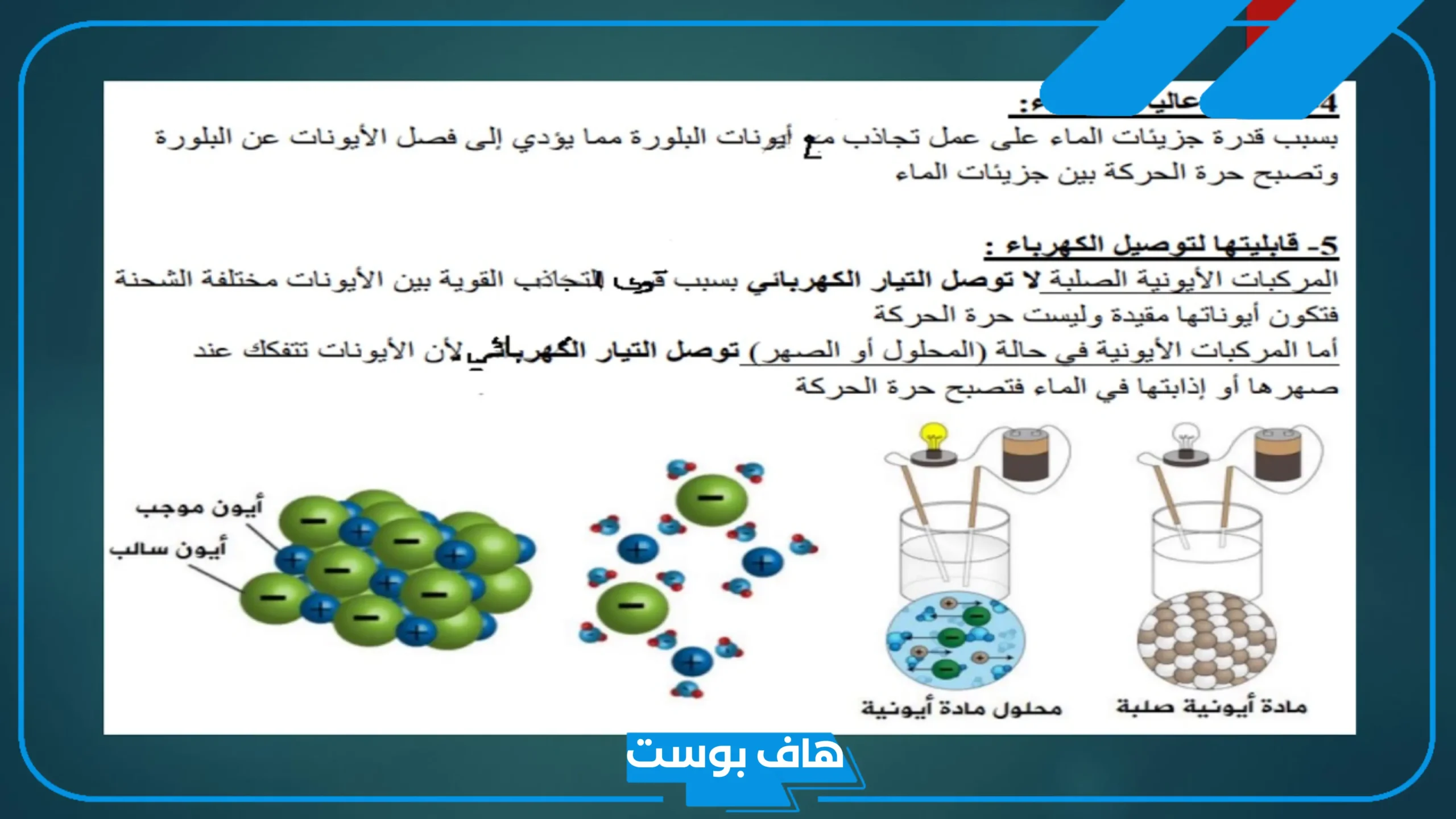
- كما تتميز بقدرتها الكبيرة على الذوبان في الماء، إذ تُطلق الأيونات الحرة بسهولة داخل المحلول، مما يجعلها قادرة على توصيل الكهرباء عند الذوبان أو الانصهار، في حين تظل غير موصلة في حالتها الصلبة لعدم تحرّك الأيونات داخل البنية.
- ورغم قوة الروابط، فإن المركبات الأيونية الصلبة تكون هشة، ويمكن كسرها بسهولة بسبب ترتيبها البلوري المنتظم الذي يتكوّن من أشكال هندسية متناسقة متراصة داخل الشبكة البلورية.
أمثلة على المركبات الأيونية
- بروميد الصوديوم ورمزه (NaBr)
- كلوريد الصوديوم ورمزه (NaCl)
- فلوريد الكالسيوم ورمزه (CaF₂)
- أكسيد الكالسيوم ورمزه (CaO)
- كبريتات النحاس ورمزه (CuSO₄)
- نترات البوتاسيوم ورمزه (KNO₃)
- كلوريد البوتاسيوم ورمزه (KCl)
المركبات الأيونية
- تنشأ المركبات الأيونية عندما تنتقل الإلكترونات من ذرة لأخرى، مما يخلق تجاذبًا قويًا بين الأيونات الموجبة والسالبة، وغالبًا ما يحدث ذلك بين الفلزات واللافلزات.
- وتتميز هذه المركبات بصلابتها في الظروف العادية، إضافة إلى امتلاكها درجات انصهار وغليان مرتفعة مقارنة بالمركبات التساهمية.
- كما أنها تذوب بسهولة في الماء، لتكوّن محاليل قادرة على توصيل الكهرباء بفاعلية.
أمثلة على المركبات الأيونية والتساهمية
المركبات الأيونية:
- مثل فلوريد الكالسيوم (CaF₂) و أكسيد المغنيسيوم (MgO)، وهي مركبات تتكوّن من اتحاد أيونات موجبة وسالبة بروابط قوية.
المركبات التساهمية:
- ومن أمثلتها الميثان (CH₄) و الأمونيا (NH₃)، حيث تشترك الذرات في الإلكترونات لتكوين روابط تساهمية.
مركبات تحتوي على روابط تساهمية وأيونية معًا:
- مثل كربونات الصوديوم (Na₂CO₃)، إذ تجمع بنيتها بين الروابط الأيونية بين الأيونات، وروابط تساهمية داخل مجموعة الكربونات نفسها.
خواص المركبات التساهمية
- تتكوّن المركبات التساهمية عندما تتشارك الذرات في الإلكترونات، مما يمنحها خصائص تختلف عن المركبات الأيونية.
- فهي تتميز بدرجات انصهار وغليان منخفضة نسبيًا، ولا توصل الكهرباء سواء في الحالة الصلبة أو السائلة.
- كما تميل للذوبان في المذيبات العضوية مثل الأسيتون والكحول، وغالبًا ما توجد في صورة سوائل أو غازات أو مواد صلبة ذات بنية ضعيفة، نظرًا لكون روابطها أضعف من الروابط الأيونية.
جدول المركبات الأيونية
| المركب | الصيغة الكيميائية | الأيونات المكون منها |
| كلوريد الصوديوم | NaCl | Na⁺ , Cl⁻ |
| نترات البوتاسيوم | KNO₃ | K⁺ , NO₃⁻ |
| كبريتات الكالسيوم | CaSO₄ | Ca²⁺ , SO₄²⁻ |
| أكسيد الماغنسيوم | MgO | Mg²⁺ , O²⁻ |
| فلوريد الكالسيوم | CaF₂ | Ca²⁺ , F⁻ |
تعريف المركبات الأيونية
المركبات الأيونية هي مركبات تنشأ نتيجة انتقال الإلكترونات من ذرة إلى أخرى، مما يؤدي إلى تكون أيونات سالبة وأيونات موجبة، وترتبط هذه الأيونات فيما بينها بروابط أيونية قوية.
وفي النهاية، قد أوضحنا فهم خواص المركبات الأيونية، كما عرضنا أنه يراها آخرون مجرد خطوة لتسهيل المقارنة مع المركبات التساهمية، بالإضافة إلى أمثلة المركبات الأيونية والتساهمية التي تمنح القارئ تصورًا سريعًا للفروق بينهما.